Практически неограниченные возможности получения рГР послужили стимулом для изучения эффективности и безопасности терапии с его применением, поиску оптимальных способов его использования и режимов дозирования. Впервые рекомбинантный человеческий гормон роста (рГР) был синтезирован в 1981 г. биотехнологической корпорацией Genentech (Сан-Франциско, Калифорния) [1].
Ранее для лечения гипофизарного нанизма применялся экстрагируемый из кадаверных гипофизов человека гормон роста [2]. В 1975 г. Н.А. Зарубиной была опубликована первая отечественная монография на тему «Гипофизарный нанизм (клиника, диагностика, дифференциальная диагностика, лечение)», где был обобщен опыт лечения гипофизарных карликов. Однако использование гормона роста человека, полученного из трупных гипофизов, сопровождалось рядом ограничений и рисков, а развитие у пациентов болезни Крейтцфельдта-Якоба подвигло к поиску альтернативных способов получения ГР. Поэтому широкое применение в клинической практике ГР получил только в конце 80-х — начале 90-х гг. прошлого столетия, после того как рекомбинантные технологии позволили производить его в неограниченных количествах.
Гормон роста стал вторым рекомбинантным препаратом, который был введен в клиническую практику вслед за инсулином. Поскольку исчезли ограничения в производстве гормона роста, начался этап активных клинических исследований с целью оптимизации лечения в отношении дозировки, времени введения и длительности применения препарата. В последующие годы рГР был одобрен для лечения различных форм низкорослости, было доказано, что он улучшает как конечный рост, так и влияет на многие обменные процессы в организме, в том числе улучшает психологические и социальные параметры.
В настоящее время создано множество препаратов рГР по всему миру: Сайзен («Мерк-Сероно», Италия), Хуматроп («Эли Лили», США), Омнитроп («Сандоз», Австрия), Генотропин («Пфайзер», США), Нордитропин («Ново Нордиск», Дания), Джинтропин («Дженсайенс», Китай) и другие. В Российской Федерации первый опыт применения соматропина датируется началом 90-х гг. XX века [3].
В 2006 году в Российской Федерации был зарегистрирован первый отечественный препарат рекомбинантного гормона роста — Растан. Высокая эффективность и безопасность длительного ежедневного применения рГР доказаны многолетним опытом его применения.
Таким образом, благодаря своевременной диагностике и доступности этиотропной терапии дети, ранее обреченные быть карликами, достигают целевых показателей роста и вырастают до 160–180 см.
ЭПИДЕМИОЛОГИЯ
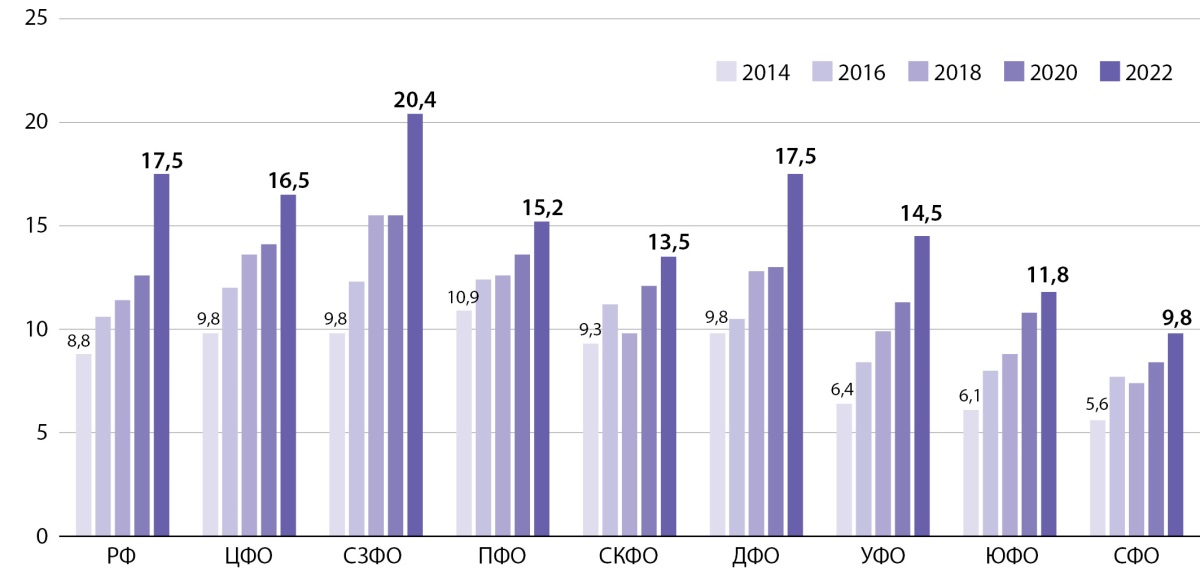
По данным зарубежных источников, распространенность соматотропной недостаточности составляет 1–4 случая на 10 000 детей [4]. В Российской Федерации дефицит гормона роста составляет 1–2 случая на 10 000 детского населения. Распространенность соматотропной недостаточности в России за 9-тилетний период (2014–2022 гг.) составляет 17,5 на 100 000 детей и не одинакова в разных федеральных округах страны (рис. 1). Максимальная распространенность заболевания выявлена в Северо-Западном федеральном округе — 20,4 на 100 000 детей, меньше всего — в Сибирском (9,8 на 100 000 детей) и Южном федеральных округах (11,8 на 100 000 детей). Показатели встречаемости соматотропной недостаточности в Приволжском, Центральном и Дальневосточном федеральных округах близки к среднероссийским (15,2; 16,5 и 17,5 на 100 000 детского населения соответственно). В Северо-Кавказском и Уральском ФО заболевание встречается соответственно у 13,5 и 14,5 на 100 000 детей. Несмотря на территориальные различия имеется общая тенденция к увеличению распространенности заболевания во всех регионах Российской Федерации, в целом по стране распространенность за 9 лет увеличилась практически в 2 раза: с 8,8 до 17,7 на 100 000 детей.
СТГ-ДЕФИЦИТ У ДЕТЕЙ
Лечение СТГ-дефицита у детей является первым и основным показанием к заместительной терапии гормоном роста [5][6]. Длительные наблюдения подтверждают, что при своевременно установленном диагнозе у детей возможно достижение целевых показателей роста. Многолетний опыт лечения детей с соматотропной недостаточностью в Институте детской эндокринологии доказал эффективность и безопасность длительной терапии рГР на большой когорте российских пациентов. Детальный анализ длительной терапии гормоном роста 422 пациентов (202 девочки и 220 мальчиков) показал, что суммарная прибавка в росте составила у лиц мужского пола — 58,4 см, у лиц женского пола — 52,8 см. В итоге конечный рост у подростков, лечившихся в среднем 7 лет (от 6,0 до 10,5 мальчики и от 5,0 до 10,0 лет девочки), составил 174,7 см (173,0–179,5 см) у юношей и 162,3 см (158,8–164,4 см) у девушек. При этом разница между показателями прогнозируемого конечного роста и достигнутым ростом составила всего 1,3 см у юношей и 0,8 см у девушек. А у некоторых подростков SDS конечного роста даже превосходила SDS генетически прогнозируемого роста.
Метаболический эффект соматропина приводил к повышению общего тонуса организма, увеличению мышечной силы, нормализации липидного и углеводного обменов, повышению сердечного выброса и улучшению минерализации костей.
В течение последних 30 лет в Институте детской эндокринологии ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России ведется системная работа по изучению функциональной системы, регулирующей синтез и секрецию СТГ, включая регуляторные белки гипоталамуса, гормоны гипофиза, ростовые и транскрипционные факторы, а также широкий спектр метаболических и системных эффектов СТГ в различные возрастные периоды.
Начало 1990-х гг. ознаменовалось началом активного изучения причин гипофизарного нанизма. Одной из первых в мире, совместно с Yamashita S. и другими японскими учеными., Фофанова О.В., изучая множественный дефицит гормонов аденогипофиза (МДГА), выявила дефекты в генах PIT1 и PROP1 [7–16]. Эти исследования были опубликованы в ведущих зарубежных журналах, признаны мировым научным сообществом и многократно цитируются по сей день. При исследовании гена гормона роста (GH1) и гена рилизинга гормона роста (GHRH) как причины изолированного дефицита гормона роста (ИДГР) у детей были выявлены различные молекулярные дефекты (делеции, сдвиги рамки считывания, нонсенс и миссенс-мутации, а также сплайсинг-мутации) [17–19].
Большой вклад в изучение причин низкорослости внесли исследования Тюльпакова А.Н. [6] и Рубцова П.М. При их непосредственном участии активно изучался рецептор гормона роста (GHR), ответственный за развитие синдрома Ларона [20][21]. Одновременно с этим Пятушкиной Г.А. проводились исследования полиморфизма гена рецептора гормона роста (GHR) [22].
Молекулярно-генетические исследования различных причин низкорослости, проведенные в конце 90-х гг. XX века, привели к формулированию понятия клинической гетерогенности и разного ростового эффекта на применение гормона роста.
Изучение синдромальной патологии роста продолжалось, и в 1997 году в мире был открыт SHOX-ген, локализованный на коротком плече Х или Y-хромосомы, ответственный за развитие низкорослости при синдромах Шерешевского-Тернера и Лери-Вейлла [23]. Исследования Шандина А.Н. выявили мутации этого гена у 1,2% детей с идиопатической низкорослостью [24][25]. Эти данные легли в основу детального изучения эффективности терапии рГР при синдроме Шерешевского-Тернера Панкратовой М.С. [26].
Проведенные исследования послужили основой для последующего изучения проблемы низкорослости у детей А.В. Витебской. Большой интерес представляло изучение причин идиопатической «семейной» низкорослости и синдромальных форм задержки роста, а также выработка показаний для назначения терапии рГР при подобных состояниях [27]. Первые исследования, рассматривающие возможность развития идиопатического СТГ-дефицита вследствие аутоиммунного гипофизита, проводились еще О.В. Фофановой и датируются 1993 годом [28].
Изучение причин низкорослости у детей развивалось быстрыми темпами, привлекая все большее внимание медицинского сообщества, и в 2005 г. О.А. Чикулаева завершила наши исследования, касающиеся молекулярно-генетических особенностей врожденной соматотропной недостаточности у детей в рамках европейской программы GeNeSIS. Были получены новые данные о встречаемости различных вариантов молекулярно-генетических дефектов при соматотропной недостаточности у детей в российской популяции [29].
Не только молекулярные основы, но и клинические проявления СТГ-дефицита были предметом изучения детских эндокринологов. В ходе изучения метаболических эффектов гормона роста Н.Н. Волеводз было выявлено, что у 58% детей с СТГ-дефицитом выявляется гиперхолестеринемия, остеопороз — у 36%, остеопения — у 47% детей, также было отмечено снижение размеров сердца относительно возраста [30].
За комплексные достижения в изучении нарушений секреции гормона роста при различных заболеваниях эндокринной системы у детей академику РАН, профессору В.А. Петерковой в 2004 г. была вручена национальная премия лучшим врачам России «Призвание» в номинации «За создание нового направления в медицине».
В 2005 г. на основании анализа зарубежных исследований и отечественного опыта применения гормона роста был разработан и опубликован первый Национальный консенсус по лечению соматотропной недостаточности [31], который позже был актуализирован и является по настоящее время основным документом, регламентирующим диагностику и лечение детей и подростков с соматотропной недостаточностью [32].
На протяжении последних 15 лет все дети с доказанной соматотропной недостаточностью обеспечиваются соматотропином за счет средств федерального бюджета. Проведенный М.В. Воронцовой медико-экономический анализ различных аспектов лечения детей с гипофизарным нанизмом доказал, что терапия детей в рамках государственной программы высокозатратных нозологий является клинически и экономически эффективной [33][34].
В последние годы стремительно развиваются знания об этиологических, патогенетических и молекулярно-генетических основах низкорослости. Понимание особенностей органогенеза гипофиза, физиологической роли СТГ в регуляции роста привело к открытию ряда моногенных форм гипопитуитаризма, характеризующихся уникальной клинической картиной. В настоящее время известен целый ряд генов, ответственных за закладку и развитие структурных элементов гипофиза и синтез гормонов, таких как: PROP1, POU1F1, PTX, LIF, HESX1, RPX3, LHX3, LHX4, SOX2, SOX3, GLI2, OTX2, GH1, GHPHR, RNPC3, IGSF1, TBL1X, TBX19, PCSK1, TCF7L1, PROKR2, FGFR1, FGF8, KAL1, ROBO1, ARNT2, PNPLA6, KCNQ1. С каждым годом эта информация обновляется и дополняется.
Накопленные данные о молекулярно-генетических основах синдрома низкорослости у детей помогают раскрывать причины редких заболеваний и назначать для их лечения персонифицированную терапию.
В настоящее время в зависимости от ситуации существует большой спектр генетических исследований для поиска причины низкорослости. Есть возможность изучить отдельный ген, панель генов (например, панель «Гипопитуитаризм», включающую 23 наиболее часто встречающихся гена, ответственных за развитие гипофизарного нанизма), а также провести полноэкзомное секвенирование. Благодаря поддержке Национальной благотворительной программы помощи детям с эндокринными заболеваниями «Альфа-Эндо» молекулярно-генетическое исследование при необходимости доступно всем детям из любого региона страны в лаборатории генетики моногенных эндокринных заболеваний ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
В дифференциальной диагностике различных форм низкорослости используется кариотипирование и хромосомный микроматричный анализ, особенно в случаях синдромальной низкорослости.
Результаты молекулярно-генетического исследования 625 детей выявили у 20,5% генетическую причину гипопитуитаризма. Чаще всего встречались варианты в гене PROP1 (44% — 56 пациентов, из них 16 сибсов), GH1 (13% — 17 пациентов), POU1F1 (7% — 9 пациентов) GLI2 (7% — 9 пациентов), GHRHR (5,5% — 7 пациентов), IGSF1 (4% — 5 пациентов), HESX1 (3% — 4 пациента) и др. (рис. 2).
Данное многолетнее исследование, в котором принимали участие детские эндокринологи из различных регионов Российской Федерации, позволило найти причину многих редких моногенных форм гипопитуитаризма. Так, только за последние 5 лет были выявлены 52 пациента с редкими синдромальными формами низкорослости (2 ребенка с артрогриппозом с холестазом (VPS33B), 1 — с синдромом Саньяд-Сакати (TBCE), 2 — с синдромом Рубинштейна-Тейби (CREBBP), 1 — с синдромом Робинов (DVL1), 3 — с синдромом Ройфмана (RNU4ATAC), 5 — с «3-М» синдромом (CUL7), 3 — с синдромом Аарского-Скотта (FGD1), 2 — с синдромом Плавающей гавани (SRCAP), 5 — с синдромом Секкеля (CENPJ, CEP63, RBBP8), 2 — с анемией Фанкони (ATR), 8 — с дефектом гена аггрекана (ACAN) и др.)
Таким образом, медико-генетические исследования последних лет существенно расширяют наши знания о причинах синдромальной низкорослости.
Планирующиеся исследования направлены на изучение редких моногенных форм гипопитуитаризма у детей и выявление гено-фенотипических корреляций при этой патологии для разработки персонализированного подхода к лечению и наблюдению.
СТГ-ДЕФИЦИТ У ВЗРОСЛЫХ
Гормон роста синтезируется в течение всей жизни и обладает не только рост-стимулирующим эффектом. Он определяет величину и силу мышечной массы, массу и минеральную плотность кости [35], регулирует жировой и углеводный обмен, объем внеклеточной жидкости [36], влияет на различные функции ЦНС, обладает влиянием на иммунитет. Как анаболический гормон он необходим на протяжении всей жизни взрослого человека. Продолжительность жизни больных с гипофизарной карликовостью без лечения на 20–30 лет короче общепопуляционной.
Первые плацебо-контролируемые долгосрочные исследования, посвященные терапии СТГ-дефицита у взрослых пациентов, датируются 1989 г. [37][38]. В Российской Федерации изучение влияния дефицита ГР у взрослых пациентов с соматотропной недостаточностью началось в конце 90-х гг. XX века.
Исследования Е.В. Нагаевой включали изучение композиционного состава тела, подбор оптимальной дозы препарата рГР у взрослых пациентов, особенности течения гипопитуитаризма [39][40].
К 2005 г. были подведены итоги и доказана эффективность и безопасность применения рГР у лиц старше 18 лет (О.Б. Безлепкина и соавт.) [41–43].
Клиническая картина дефицита СТГ у взрослых проявляется, помимо карликовости, висцеральным ожирением, гиперлипидемией, дислипидемией, характерно развитие нарушений углеводного обмена (инсулинорезистентность, нарушение толерантности к глюкозе). Заместительная терапия рГР с использованием метаболической дозы (в 7–10 раз меньше ростостимулирующей дозы) помогает нормализовать показатели липидного обмена и улучшить минеральную плотность костной ткани. Установлено, что ГР обладает выраженным эффектом на процессы ремоделирования костной ткани. Денситометрические исследования выявили прогрессирующую остеопению и снижение процессов остеосинтеза при соматотропной недостаточности [35]. Доказано, что у лиц, получающих заместительную терапию рГР, нормализуются процессы ремоделирования костной ткани [44].
Существуют многочисленные данные о повышенном риске сердечно-сосудистых заболеваний и смертности у взрослых с СТГ-дефицитом (диастолическая дисфункция миокарада, нарушение проводимости, сократимости, уменьшение массы миокарда, снижение фракции выброса) [45][46]. А на фоне же лечения рГР происходит улучшение функции миокарда. Эти данные послужили основой для использования р-ГР при миокардитах, миокардиодистрофиях и сердечной недостаточности с положительным эффектом [47].
ОБЕСПЕЧЕНИЕ ПАЦИЕНТОВ ГОРМОНОМ РОСТА В РФ
На протяжении последних 15 лет в Российской Федерации все дети с доказанной соматотропной недостаточностью (гипофизарным нанизмом) бесплатно обеспечиваются соматотропином, который входит в перечень централизованно закупаемых за счет средств федерального бюджета лекарственных средств (действующий документ — Распоряжение Правительства РФ №2738-р от 10.12.2018 г.).
Государственная поддержка пациентов с дефицитом гормона роста масштабно началась в конце 2008 г., когда была создана программа «Высокозатратные нозологии» (ВЗН), первоначально она включала 7 нозологий, в том числе «гипофизарный нанизм». Спустя некоторое время — в 2019 г. — программа включала в себя уже 12 высокозатратных нозологий, а в 2020-м — 14 нозологий. При этом гипофизарный нанизм всегда был и остается неотъемлемой частью программы, что позволяет полноценно обеспечивать всех детей с соматотропной недостаточностью необходимым лечением и анализировать эффективность терапии рГР.
Сотрудниками Минздрава России совместно с экспертами — детскими эндокринологами Института детской эндокринологии — в целях осуществления государственных закупок проводится ежегодная экспертиза всех случаев соматотропной недостаточности у детей в России с последующим обеспечением их гормоном роста. С 2023 г. финансирование этих закупок стало проводиться при участии фонда поддержки детей с тяжелыми жизнеугрожающими и хроническими заболеваниями, в том числе редкими (орфанными) заболеваниями «Круг добра».
Начиная с 2022 г. взрослые с впервые выявленным СТГ-дефицитом, а также молодые люди старше 18 лет с соматотропной недостаточностью после проведения ретестирования и подтверждения соматотропной недостаточности имеют возможность обеспечения рГР в рамках программы «14 высокозатратных нозологий». Не подлежат ретестированию подростки с подтвержденной молекулярно-генетической причиной заболевания и рядом других состояний, указанных в Консенсусе по диагностике соматотропной недостаточности [32].
Реестр пациентов с соматотропной недостаточностью на конец 2023 г. включал в себя 4639 пациентов (4520 детей и 119 взрослых).
ГОРМОН РОСТА ПРИ ЗАБОЛЕВАНИЯХ, НЕ СВЯЗАННЫХ С СОМАТОТРОПНОЙ НЕДОСТАТОЧНОСТЬЮ
Новые достижения привели к расширению клинического применения гормона роста, что открыло новые возможности в лечении других форм низкорослости. Это важный прогресс, который нельзя не отметить.
Еще в 1983 г. на Международной конференции по применению гормона роста возник вопрос о необходимости его использования у низкорослых детей, не имеющих СТГ-дефицита. Доступность рГР позволила проводить исследования его эффективности при различных негипофизарных причинах низкорослости. Целью терапии низкорослых детей без соматотропной недостаточности является увеличение скорости роста и нормализация линейного роста без воздействия на основные причины их заболевания. Рекомбинатный ГР применяется при различных состояниях, таких как синдромальная низкорослость (например, синдромы Шерешевского-Тернера, Сильвера-Рассела, Прадера-Вилли, Де Груши), хроническая почечная недостаточность, длительная терапия глюкокортикоидами в анамнезе, внутриутробная задержка роста, идиопатическая низкорослость, ювенильный идиопатический артрит, заболевания кроветворной системы, нейрофиброматоз, муковисцидоз и др. При всех этих заболеваниях низкорослость вызвана не соматотропной недостаточностью, для таких пациентов характерен дозозависимый характер эффективности ГР и проводится очень внимательный мониторинг.
В Российской Федерации, кроме соматотропной недостаточности, у детей и взрослых лечение гормоном роста одобрено при ХПН, синдроме Шерешевского-Тернера, синдроме Прадера-Вилли, низкорослости вследствие задержки внутриутробного развития.
СИНДРОМ ШЕРЕШЕВСКОГО-ТЕРНЕРА (СШТ)
Терапия рГР применяется для увеличения роста у пациенток с СШТ, что позволяет им достичь роста, близкого к нормальному. В среднем использование рГР увеличивает рост пациенток на 5–8 см за 5–7 лет терапии, что, безусловно, демонстрирует его эффективность. Возраст начала и длительность лечения рГР влияет на конечный рост, поэтому очень важно начинать терапию как можно раньше, чтобы предотвратить замедление скорости роста, характерное для девочек с СШТ первых лет жизни. Оптимальный возраст начала терапии рГР при СШТ не определен, в большинстве стран лечение инициируют после 4 лет. Начальная доза рГР при СШТ составляет 0,05 мг/кг в сутки с последующей коррекцией в зависимости от ростового эффекта. При своевременно начатом лечении рГР большинство исследователей рекомендуют начинать лечение эстрогенами с 9–12 лет [26, 48].
В 2023 г. фонд поддержки детей с тяжелыми жизнеугрожающими и хроническими заболеваниями, в том числе редкими (орфанными) заболеваниями, «Круг добра» взял на себя обеспечение соматропином пациенток с генетически подтвержденным синдромом Шерешевского-Тернера. Установлены следующие критерии для начала лечения: возраст от 4 до 14 лет; задержка роста до начала лечения (SDS роста для популяции ≤2,0) и рентгенологически установленный костный возраст меньше 13 лет. В настоящее время происходит экспертиза заявок и включение детей с СШТ в программу лечения.
ЗАДЕРЖКА ВНУТРИУТРОБНОГО РАЗВИТИЯ (ЗВУР)
В отдельную нозологию выделена низкорослость, обусловленная задержкой внутриутробного развития. Первое крупное рандомизированное исследование продолжительного применения рГР у этой когорты детей датируется 1990 г. Наличие ЗВУР в анамнезе связывают с повышенным риском развития низкорослости, раним началом с быстрым прогрессированием полового созревания, нейро-когнитивными дисфункциями, метаболическими изменениями (сниженная плотность костей, нарушения углеводного обмена, дислипидемии), повышенным риском сердечно-сосудистых заболеваний в более позднем возрасте. У подавляющего большинства детей со ЗВУР наблюдается спонтанное догоняющее развитие в первые годы жизни.
В Институте детской эндокринологии ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России в течение последних 20 лет проводятся наблюдение и при необходимости лечение низкорослых детей со ЗВУР. Е.В. Нагаевой изучен большой спектр клинических, гормональных, метаболических особенностей у пациентов со ЗВУР [49]. Многолетний опыт применения рГР у детей со ЗВУР доказал, что предикторами эффективности терапии являются доза препарата и сроки инициации терапии (как и при СТГ-дефиците предпочтительным является раннее начало терапии) [50].
Кроме того, гормон роста применяется в терапии низкорослости, обусловленной длительной терапией глюкокортикоидами у детей, для которых характерна супрессия активности центрального и периферического звена рострегулирующей системы. Совместно с клиникой Сеченовского Университета изучался вопрос применения рГР у детей с ревматическими заболеваниями, была показана эффективность и безопасность лечения этой когорты детей [51].
Хроническая почечная недостаточность (ХПН), характеризующаяся развитием уремии и связанной с ней потерей баланса между ИФР1 и ИФРСБ-3, также приводит к задержке роста у детей [52][53], при этом наиболее выраженную низкорослость имеют дети с врожденными нарушениями [54]. Зарубежный и наш опыт свидетельствует об эффективности и безопасности лечения этой группы детей, низкорослость при ХПН у детей — одно из первых, не обусловленных СТГ-дефицитом состояний, одобренных для лечения рГР.
Перспективным направлением считалось и считается применение рГР в геронтологии. Первые сообщения об улучшении композиционного состава тела у пожилых мужчин с низкими уровнями ИФР-1 в плазме в ответ на инъекции рГР, опубликованное в 1990 г. [55], привлекло огромное внимание к рГР как к «антивозрастному» средству. Многие исследователи полагают, что изучение роли СТГ в процессах старения, механизме взаимодействия с факторами окружающей среды приведут к новым знаниям, важным как для индивидуального, так и для общественного здоровья [56].
Гормон роста также играет роль в поддержании скелетной массы у взрослых. Он стимулирует хондроциты и остеобласты, являющиеся клетками-предшественниками, участвующими в пролиферации и дифференцировке. В связи с описанными эффектами СТГ на костную ткань, предпринимались попытки назначения рГР людям с остеопорозом без СТГ-дефицита. Gonnelli S. и др. в своем плацебо-контролируемом исследовании показали, что у женщин в постменопаузальный период лечение рГР при остеопорозе увеличивает обмен костной ткани. Комбинированное лечение рГР и кальцитонином в течение 2 лет повышает и поддерживает МПК в позвоночнике и лучевой кости, снижая МПК бедренной кости [57]. В другом исследовании Barake M. с соавт. показали, что терапия рГР не всегда улучшает плотность костной ткани у женщин с возрастной потерей костной массы, но в большинстве случаев снижает риск переломов [58].
ПЕРСПЕКТИВЫ: ПРЕПАРАТЫ СТГ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ
Необходимость ежедневного подкожного введения рГР в течение многих лет часто является препятствием к оптимальному соблюдению режима лечения. Многие годы исследователи были сосредоточены на разработке препаратов СТГ длительного действия с целью продления периода полувыведения молекулы СТГ и снижения частоты введения.
В 2013 г. Европейским агентством лекарственных средств (EMA) был одобрен зарегистрированный ранее в Южной Корее депо — препарат LB03002 для еженедельного подкожного введения (www.ema.europa.eu/en/medicines/human/EPAR/somatropin-biopartners). Однако разрешение на его использование было отозвано ввиду того, что он не поступил в продажу в течение 3 лет.
В настоящее время активно проводятся исследования минимум восьми препаратов, в пяти случаях идет исследование III фазы [59]. При этом, в отличие от рГР, представляющего собой один пептид массой 22 кДА, производимый аналогичным всеми фармакологическими компаниями, каждый из препаратов длительного действия представляет собой отдельный химический субстрат, со своим профилем фармакокинетики и фармакодинамики. Mameli С. и соавт. в 2023 г. представили крупный метаанализ всех изучаемых препаратов СТГ длительного действия с 2012 по 2022 гг. и пришли к выводу о том, что в отношении эффективности и безопасности все доступные препараты были аналогичны рГР для ежедневного использования [60].
Таким образом, мы являемся свидетелями начала и широкого внедрения в клиническую практику лечения дефицита гормона роста как у детей, так и у взрослых. Казавшееся когда-то невероятным, становится рутинной практикой каждого детского эндокринолога. Развитие молекулярной генетики расширяет наше понимание основ гипопитуитаризма. Кто знает, возможно, следующие 10–20 лет ознаменуются появлением и генно-инженерной терапии, что позволит говорить о полной ликвидации карликовости.
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Источники финансирования. Работа проведена в рамках темы госзадания 123021000045–4 «Генетическая персонификация редких вариантов задержки роста и полового развития у детей».
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Райкина Е.Н., Панкратова М.С., Нагаева Е.В. — аналитическая работа и подготовка финальной версии статьи; Безлепкина О.Б., Петеркова В.А., Дедов И.И. — редактирование текста, внесение ценных замечаний. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
Список литературы
↑1. Michael J. Cronin, Pioneering recombinant growth hormone manufacturing: Pounds produced per mile of height. The Journal of Pediatrics. Volume 131. Issue 1, Supplement, 1997, Pages S5-S7,ISSN 0022-3476, https://doi.org/10.1016/S0022-3476(97)70002-7
↑2. Зарубина Н.А. Анаболические стероиды и гормон роста человека в терапии церебрально-гипофизарного нанизма: Автореферат дисс... канд. мед. наук. - Москва, 1964. - 16 с.
↑3. Дедов И.И., Петеркова В.А., Гончаров Н.П. и др. Опыт использования генно-инженерного гормона роста SAISEN для лечения детей с соматотропной недостаточностью: результаты клинической апробации в России // Проблемы Эндокринологии. - 1994;40(6):30-34. https://doi.org/10.14341/probl12189
↑4. Bosch I Ara L, Katugampola H, Dattani MT. Congenital Hypopituitarism During the Neonatal Period: Epidemiology, Pathogenesis, Therapeutic Options, and Outcome. Front Pediatr. 2021 Feb 2;8:600962. https://doi.org/10.3389/fped.2020.600962
↑5. Габибов А.Г., Пономаренко Н.А., Воробьев И.И. и др. Перспективы создания отечественных генно-инженерных препаратов для медицины. Растан - первый отечественный рекомбинантным гормон роста человека // Проблемы Эндокринологии. 2007;53(2):19-24. https://doi.org/10.14341/probl200753219-24
↑6. Дедов И.И., Тюльпаков А.Н., Петеркова В.А. Соматотропная недостаточность. М.: Индекс Принт; 1998.
↑7. Fofanova OV, Takamura N, Kinoshita E, et al. Rarity of PIT1 involvement in children from Russia with combined pituitary hormone deficiency. Am J Med Genet. 1998;77:360-5. https://doi.org/10.1002/(sici)1096-8628(19980605)77:5<360::aid-ajmg4>3.0.co;2-r
↑8. Fofanova OV, Takamura N, Kinoshita E, et al. A mutational hot spot in the Prop-1 gene in Russian children with combined pituitary hormone deficiency. Pituitary. 1998;1:45-9. https://doi.org/10.1023/a:1009918924945
↑9. Takamura N, Fofanova OV, Kinoshita E, et al. Gene analysis of PROP1 in dwarfism with combined pituitary hormone deficiency. Growth Horm IGF Res. 1999;9 Suppl B:12-7. https://doi.org/10.1016/s1096-6374(99)80075-6
↑10. Fofanova O, Takamura N, Kinoshita E, et al. Compound heterozygous deletion of the PROP-1 gene in children with combined pituitary hormone deficiency. J Clin Endocrinol Metab. 1998;83:2601-4. https://doi.org/10.1210/jcem.83.7.5094
↑11. Cogan JD, Wu W, Phillips JA, et al. The PROP1 2-base pair deletion is a common cause of combined pituitary hormone deficiency. J Clin Endocrinol Metab. 1998;83:3346-9. https://doi.org/10.1210/jcem.83.9.5142
↑12. Obermannova B, Pfaeffle R, Zygmunt-Gorska A, et al. Mutations and pituitary morphology in a series of 82 patients with PROP1 gene defects. Horm Res Paediatr. 2011;76:348-54. https://doi.org/10.1159/000332693.
↑13. Joy D. Cogan, Wei Wu, John A. Phillips, et al. The PROP1 2-Base Pair Deletion Is a Common Cause of Combined Pituitary Hormone Deficiency. The Journal of Clinical Endocrinology & Metabolism. Volume 83, Issue 9, 1 September 1998, Pages 3346-3349, https://doi.org/10.1210/jcem.83.9.5142
↑14. Fofanova O, Takamura N, Kinoshita E, et al. Compound heterozygous deletion of the PROP-1 gene in children with combined pituitary hormone deficiency. J Clin Endocrinol Metab. 1998 Jul;83(7):2601-4. https://doi.org/10.1210/jcem.83.7.5094
↑15. Фофанова О.В. Клинический полиморфизм и молекулярногенетическая гетерогенность соматотропной недостаточности у детей. Автореферат дисс. ... докт. мед. наук. - Москва, 1999. - 281 с.
↑16. Гаврилова А.Е., Нагаева Е.В., Ширяева Т.Ю. и др. Клиникогенетические особенности пациентов с множественным дефицитом гормонов аденогипофиза, обусловленным мутациями в гене PROP1: эффективность терапии рекомбинантным гормоном роста // Проблемы Эндокринологии. 2017;63(2):72-81. https://doi.org/10.14341/probl201763272-81
↑17. Фофанова О.В., Евграфов О.В., Поляков А.В. и др. Мутации сплайсинга гена GH-1 как молекулярная основа наследственного изолированного дефицита гормона роста у детей // Бюллетень экспериментальной биологии и медицины. 2006 г; 141(3): 324-329
↑18. Fofanova OV, Evgrafov OV, Polyakov AV, et al. A novel splicing mutation in exon 4 (456G>A) of the GH1 gene in a patient with congenital isolated growth hormone deficiency. Hormones (Athens). 2006;5:288-94. https://doi.org/10.14310/horm.2002.11194
↑19. Fofanova OV, Evgrafov OV, Polyakov AV, et al. A novel IVS2 -2A>T splicing mutation in the GH-1 gene in familial isolated growth hormone deficiency type II in the spectrum of other splicing mutations in the Russian population. J Clin Endocrinol Metab. 2003;88:820-6. https://doi.org/10.1210/jc.2002-020269.
↑20. Tiulpakov AN, Orlovsky IV, Kalintchenko N U, et al. Growth hormone insensitivity (Laron syndrome) in a Russian girl of slavic origin caused by a common mutation of the GH receptor gene. Journal of Endocrine Genetics. - 2000. - Vol. 1, №2. - P. 95-100. https://doi.org/10.1515/IJDHD.1999.1.2.95
↑21. Tiulpakov A, Rubtsov P, Dedov I6 et al. A novel C-terminal growth hormone receptor (GHR) mutation results in impaired GHR-STAT5 but normal STAT-3 signaling. J Clin Endocrinol Metab. 2005;90:542-7. https://doi.org/10.1210/jc.2003-2133
↑22. Пятушкина Г.А. Полиморфизм гена рецептора гормона роста и эффективность рекомбинантных препаратов гормона роста: Дис. ... канд. мед. наук. - Москва, 2008. - 162 с.
↑23. Витебская А.В. Клинические синдромы, связанные с SHOX-геном. Проблемы Эндокринологии. 2004; 50(2): 10-15. https://doi.org/10.14341/probl11387
↑24. Шандин А.Н., Нагаева Е.В., Петеркова В.А. и др. Эффективность и безопасность применения рекомбинантного гормона роста у детей с идиопатической низкорослостью // Проблемы Эндокринологии. 2010;56(6):14-23. https://doi.org/10.14341/probl201056614-23
↑25. Шандин А.Н. Клинические варианты и молекулярные основы идиопатической низкорослости у детей: Дис. ... канд. мед. наук. - Москва, 2011. - 124 с.
↑26. Панкратова М.С. Ростовые и метаболические эффекты терапии рекомбинантным гормоном роста и половыми стероидами у девочек с синдромом Шерешевского-Тернера: Дис. ... канд. мед. наук. - Москва, 2009. - 121 с.
↑27. Витебская А.В. Антропометрические, гормональные, рентгенологические и молекулярно-генетические проявления идиопатической низкорослости у детей: Дис. ... канд. мед. наук. - Москва, 2003. - 152 с.
↑28. Фофанова О.В., Петеркова В.А., Крюкова И.В. и др. Соматотропная недостаточность у детей и антигипофизарные антитела как показатели гуморального аутоиммунитета у пациентов и их родителей. Проблемы эндокринологии. - 1993. - Т. 42, №3. - С. 10-15. - https://doi.org/10.14341/probl12035
↑29. Чикулаева О.А. Молекулярно-генетические, гормональные и иммунологические особенности врожденной соматотропной недостаточности у детей: Дис. ... канд. мед. наук. - Москва, 2005. - 166 с.
↑30. Волеводз Н.Н. Системные и метаболические эффекты гормона роста у детей с различными вариантами низкорослости: Дис. ... канд. мед. наук. - Москва, 2005. - 281 с.
↑31. Петеркова В.А., Фофанова О.В., Тюльпаков А.Н. и др. Диагностика и лечение соматотропной недостаточности у детей: Национальный Консенсус. Москва: АСК Юнион Печатные работы, 2005. - 5 с.
↑32. Нагаева Е.В., Ширяева Т.Ю., Петеркова В.А. и др. Российский национальный консенсус. Диагностика и лечение гипопитуитаризма у детей и подростков // Проблемы Эндокринологии. 2018;64(6):402-411. https://doi.org/10.14341/probl10091
↑33. Воронцова М.В. Лечение детей с гипофизарным нанизмом препаратами гормона роста: медицинские и экономические аспекты: Дис. ... канд. мед. наук. - Москва; 2017. - 157 с.
↑34. Воронцова М.В., Нагаева Е.В., Найговзина Н.Б. Экономические и социальные аспекты лечения гипофизарного нанизма препаратами рекомбинантного гормона роста // Проблемы Эндокринологии. 2017;63(2):82-91. https://doi.org/10.14341/probl201763282-91
↑35. Bouillon R, Koledova E, Bezlepkina O, et al. Bone status and fracture prevalence in Russian adults with childhood-onset growth hormone deficiency. J Clin Endocrinol Metab. 2004;89:4993-8. https://doi.org/10.1210/jc.2004-0054
↑36. M0ller J, Frandsen E, Fisker S, et al. Decreased plasma and extracellular volume in growth hormone deficient adults and the acute and prolonged effects of GH administration: a controlled experimental study. Clin Endocrinol (Oxf). 1996;44:533-9. https://doi.org/10.1046/j.1365-2265.1996.728550.x
↑37. Salomon F, Cuneo RC, Hesp R, et al. The Effects of Treatment with Recombinant Human Growth Hormone on Body Composition and Metabolism in Adults with Growth Hormone Deficiency. N Engl J Med. 1989;321:1797-803. https://doi.org/10.1056/NEJM198912283212605
↑38. J0rgensen JO, Pedersen SA, Thuesen L, et al. Beneficial effects of growth hormone treatment in GH-deficient adults. Lancet. 1989;1:1221-5. https://doi.org/10.1016/s0140-6736(89)92328-3
↑39. Нагаева Е.В. Клинические, гормональные и метаболические проявления врожденной соматотропной недостаточности у взрослых карликов на фоне заместительной терапии гормоном роста: Дис. ... канд. мед. наук. - М.: 2002
↑40. Нагаева Е.В., Безлепкина О.Б., Гончаров Н.П. и др. Вторичный гипотиреоз: особенности диагностики и лечения // Проблемы Эндокринологии. 2002;48(6):26-30. https://doi.org/10.14341/probl11714
↑41. Луценко А.С., Нагаева Е.В., Белая Ж.Е. и др. Современные аспекты диагностики и лечения СТГ-дефицита взрослых // Проблемы Эндокринологии. 2019;65(5):373-388. https://doi.org/10.14341/probl10322
↑42. Дедов И.И., Петеркова В.А., Безлепкина О.Б., Нагаева Е.В. Соматотропная недостаточность у взрослых. - Атлас. - М.: 2004. - 89 с.
↑43. Безлепкина О.Б. Синдром гипофизарной карликовости у взрослых: диагностика, клиника, медико-социальная реабилитация: Дис. ... докт. мед. наук. - М.: 2004. - 287 с.
↑44. Tritos NA, Klibanski A. Effects of Growth Hormone on Bone. Prog Mol Biol Transl Sci. 2016;138:193-211. https://doi.org/10.1016/bs.pmbts.2015.10.008
↑45. Дедов И.И., Бондаренко И.З., Безлепкина О.Б. Эндокринные механизмы модуляции сердечной деятельности у пациентов с хронической сердечной недостаточностью: роль гормона роста // Ожирение и метаболизм. 2010;7(4):4-7. https://doi.org/10.14341/2071-8713-5080
↑46. Gazzaruso C, Gola M, Karamouzis I, et al. Cardiovascular risk in adult patients with growth hormone (GH) deficiency and following substitution with GH--an update. J Clin Endocrinol Metab. 2014;99:18-29. https://doi.org/10.1210/jc.2013-2394
↑47. Maison P, Chanson P. Cardiac effects of growth hormone in adults with growth hormone deficiency: a meta-analysis. Circulation. 2003;108:2648-52. https://doi.org/10.1161/01.CIR.0000100720.01867.1D
↑48. Peterkova V, Savoy C, Bezlepkina O, et al. Efficacy and safety of Valtropin in the treatment of short stature in girls with Turner's syndrome. J Pediatr Endocrinol Metab. 2004;17:1429-34. https://doi.org/10.1515/jpem.2004.17.10.1429
↑49. Нагаева Е.В. Рост, гормональный и метаболический статус у детей, рожденных с задержкой внутриутробного развития в разные возрастные периоды: Дис. ... докт. мед. наук. - М.: 2021. - 406 с.
↑50. Нагаева Е.В. Низкорослость, обусловленная задержкой внутриутробного развития. Клинические и гормональнометаболические особенности, возможности ростостимулирующей терапии // Проблемы Эндокринологии. 2022;68(5):4-13. https://doi.org/10.14341/probl13178
↑51. Шарова А.А., Волеводз Н.Н., Петеркова В.А. Оценка состояния рострегулирующей системы и применение рекомбинантного гормона роста (генотропина) у детей с ревматическими заболеваниями и нарушением роста на фоне длительной глюкокортикостероидной терапии // Проблемы Эндокринологии. 2002;48(6):30-35
↑52. Mak RH, Cheung WW, Roberts CT. The growth hormone-insulin-like growth factor-I axis in chronic kidney disease. Growth Horm IGF Res. 2008;18:17-25. https://doi.org/10.1016/j.ghir.2007.07.009
↑53. Gurevich E, Segev Y, Landau D. Growth Hormone and IGF1 Actions in Kidney Development and Function. Cells. 2021;10:3371. https://doi.org/10.3390/cells10123371
↑54. Sanchez CP. Growth-plate cartilage in chronic renal failure. Pediatr Nephrol. 2010;25:643-9. https://doi.org/10.1007/s00467-009-1307-6
↑55. Rudman D, Feller AG, Nagraj HS, et al. Effects of human growth hormone in men over 60 years old. N Engl J Med. 1990;323:1-6. https://doi.org/10.1056/NEJM199007053230101
↑56. Bartke A. Growth Hormone and Aging: Updated Review. World J Mens Health. 2019;37:19-30. https://doi.org/10.5534/wjmh.180018
↑57. Gonnelli S, Cepollaro C, Montomoli M, et al. Treatment of post-menopausal osteoporosis with recombinant human growth hormone and salmon calcitonin: a placebo controlled study. Clin Endocrinol (Oxf). 1997;46:55-61. https://doi.org/10.1046/j.1365-2265.1997.d01-1750.x
↑58. Barake M, Arabi A, Nakhoul N, et al. Effects of growth hormone therapy on bone density and fracture risk in age-related osteoporosis in the absence of growth hormone deficiency: a systematic review and meta-analysis. Endocrine. 2018;59:39-49. https://doi.org/10.1007/s12020-017-1440-0
↑59. Pampanini V, Deodati A, Inzaghi E, et al. Long-Acting Growth Hormone Preparations and Their Use in Children with Growth Hormone Deficiency. Horm Res Paediatr. 2023;96:553-9. https://doi.org/10.1159/000523791
↑60. Mameli C, Orso M, Calcaterra V, et al. Efficacy, safety, quality of life, adherence and cost-effectiveness of long-acting growth hormone replacement therapy compared to daily growth hormone in children with growth hormone deficiency: A systematic review and meta-analysis. Pharmacol Res. 2023 Jul;193:106805. https://doi.org/10.1016/j.phrs.2023.106805








.jpg)


